La medida del contenido de agua en un aceite aislante usamos el Titraje de Karl Fisher como técnica básica. En la titulación Karl Fisher, el agua (H2O) reacciona químicamente con el yodo (I2), dióxido de azufre (SO2), una base orgánica (C5H5C) y el alcohol (CH3OH) en un disolvente orgánico.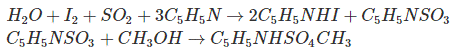
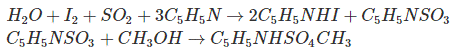
Aquí, la muestra se mezcla con dióxido de azufre, iones de yoduro y base orgánica/alcohol. Aquí, los iones de yoduro se producen por electrólisis y participan en las reacciones anteriores en la solución. Así que no habría ningún rastro de iones de yoduro individuales en la solución mientras la reacción continúe.
Los iones de yoduro producidos por la electrólisis se consumen totalmente en la reacción mientras las moléculas de agua presentes en la solución. Tan pronto como no haya más moléculas de agua para reaccionar, las reacciones de Karl Fisher se detienen. Hay dos electrodos de platino sumergidos en la solución desde el principio. Justo después de que la reacción de Karl Fisher termine, la existencia de iones de yoduro en la solución despolariza los electrodos de platino. Como resultado de los cambios en la relación voltaje-corriente del circuito de los electrodos. Así, este cambio indica el punto final de la reacción de Karl Fisher en la solución.
De acuerdo con el Ley de Faraday de la electrólisisla cantidad de yodo que participa en la reacción es proporcional a la electricidad consumida para electrolisis durante las reacciones de Karl Fisher.
A partir del consumo de electricidad hasta el final de la reacción, se puede calcular fácilmente la masa real de yodo que participa en la reacción. Una vez más, a partir de la primera ecuación de las reacciones, se encuentra que el yodo de un molar reacciona con el agua de un molar. Eso significa que 127 gramos de yodo reaccionarán con 18 gramos de agua. Así que a partir de un peso calculado de yodo, podemos determinar la cantidad exacta de agua presentada en la muestra de aceite aislante.