El objetivo es determinar la comprensión básica de los siguientes conceptos:
- Ley de Conservación de la Masa
- Derecho de la conservación de la energía
- La correlación entre la masa y la energía
- Correlación entre la energía y el trabajo
- Concepto sobre la energía total
- Primera ley de la termodinámica
Ley de Conservación de la Masa
Esta ley establece que la masa no es destructible o no puede ser creada o destruida. Según esta ley, existe una relación para el flujo de masa en diferentes secciones de una corriente de flujo. En la siguiente figura, el flujo que pasa a través de una tubería está dado por: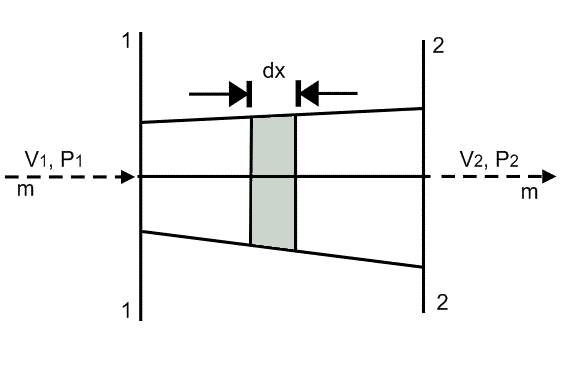

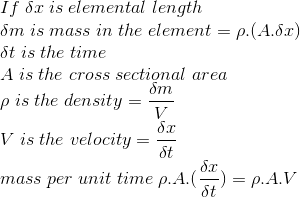
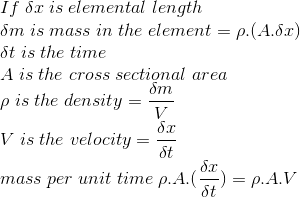
La condición de flujo de estado constante para la ecuación anterior es
La ecuación anterior es el resultado de la ley de conservación de la masa y es una ecuación unidimensional.
Derecho de la conservación de la energía
Según esta ley, la energía no debe ser destruida ni creada.
La conversión de energía de una forma a otra tuvo lugar, siempre que el sistema cambia su estado.
Eaxmples : en aplicaciones como:
- La energía potencial (PE) cambia a energía cinética (KE) durante el flujo de agua a través de la tubería.
- El K.E. de los automóviles cambia a la energía de calor durante la rotura del automóvil a causa de la fricción.
- Conversión de la energía eléctrica en calor, en caso de actual fluyen a través de un resistencia.
Por lo tanto, en cualquier proceso, la energía sólo cambia su origen y por lo tanto no cambiará la energía total del sistema y el entorno (significa el universo).
Relación entre la masa y la energía
Según la teoría de la relatividad de Einsteins sobre la masa y la energía; está claro que la masa y la energía son convertibles.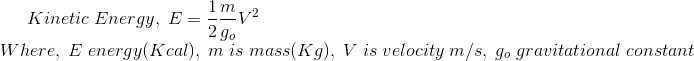
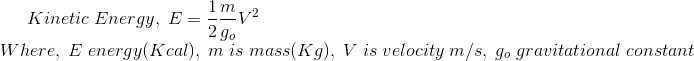
Relación entre la energía y el trabajo
La segunda ley de movimiento de Newtons proporciona el concepto de Trabajo, KE y PE.
Supongamos que si el cuerpo se mueve, su posición inicial y final y su velocidad serán respectivamente s1, s2 y V1, V2 debido a la participación del componente de fuerza F.
A partir de la segunda ley de movimiento de Newtons la magnitud del componente de fuerza (Fs) está asociado con el cambio de magnitud de V por![]()
![]()
Por encima de la Ecuación se puede reordenar como![]()
![]()
En lo anterior ds/dt es la velocidad (V) e integrando la ecuación para la posición inicial y final (s1 y s2)![]()
![]()
La integración de la ecuación anterior en ambas da![]()
![]()
El lado izquierdo de la ecuación anterior se puede equiparar a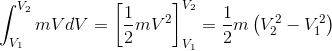
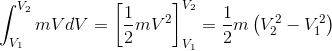
La cantidad![]()
![]()
es la Energía Cinética (KE) del cuerpo y es una cantidad escalar y extensa propiedad y el cambio en la energía cinética es dado por

La unidad de KE y el trabajo son iguales, es decir, N-m o J o KJ.
De manera similar, la energía potencial gravitacional (PE) del cuerpo es mgh y es una cantidad escalar y el cambio en la energía potencial viene dado por

Es una propiedad extensa. La unidad de PE es la misma que la de trabajo, es decir, N-m o J o KJ.
Donde, h es la elevación del cuerpo con respecto a la superficie terrestre.
El producto de la fuerza (F) y el desplazamiento (ds) se conoce como trabajo y también se puede equiparar a un cambio en la energía cinética del cuerpo. La unidad es N-m.
La potencia (P) es la tasa de transferencia de energía por el trabajo y puede ser igualada a la fuerza (F) X velocidad (V).
O
Ritmo de trabajo.
Concepto de energía total
La energía total del sistema engloba la energía cinética (KE), la energía potencial (PE) y la energía miscelánea. Los ejemplos se dan como:
- cuando el resorte se comprime. En este caso la energía se almacena dentro del resorte.
- El aumento de la energía almacenada es el ejemplo de la energía total durante batería procesos de carga.
En los ejemplos anteriores, el cambio de la energía del sistema no se debe a cambios en la energía cinética o potencial, sino a cambios en la energía interna (U).
Cuando el proceso cambia, entonces su energía interna es dada por U2 U1 y la energía específica interna está representada por u expresada en base a la unidad de masa.
El cambio de energía total viene dado por:![]()
![]()
Transferencia de energía por calor
Hasta ahora sólo hemos discutido las interacciones entre el sistema y el entorno que están relacionadas con el trabajo. Pero también es posible que un sistema cerrado interactúe con el entorno que no puede ser llamado como trabajo.
Ejemplo: cuando el gas entra en contacto con la superficie caliente de una placa en un cilindro, entonces la energía del gas aumenta aunque no se haya realizado ningún trabajo. Este proceso se llama transferencia de energía por calor.
(Q) es la cantidad de energía transferida a través de los límites de un sistema. Entonces Q dentro de un sistema se considera como positiva, mientras que Q fuera del sistema se considera como negativa.
Q > 0 (considerado como positivo) Transferencia de calor al sistema
Q < 0 (considerado como negativo) Transferencia de calor del sistema La transferencia de calor no sólo depende del estado final, sino que depende del proceso particular. De manera similar, el calor tampoco depende del estado final.
El valor de la transferencia de calor (Q) depende del proceso específico y no sólo de los estados finales. La cantidad de transferencia de energía por calor en un proceso viene dada por la integral de:![]()
![]()
Donde los límites significan del estado 1 al estado 2 y no se refieren a los valores de calor en esos estados. La notación del signo utilizada para la transferencia de calor (Q) es opuesta a la de la transferencia de trabajo (W). Un valor positivo de trabajo (W) implica transferencia de energía del sistema al entorno y viceversa.
Primera Ley de Termodinámica o Balance Energético en un Sistema Cerrado
La transferencia de energía por trabajo (W) o por calor (Q) es la única manera de cambiar la energía en el sistema cerrado. El principio subyacente es que Se conserva la energía.
Cuando la energía (calor y trabajo) cruza la frontera en un sistema, entonces la energía interna (U) del sistema obtiene un cambio y este fenómeno se llama la Primera Ley de la Termodinámica (aprende más sobre termodinámica de ingeniería)
[Cambio de energía con en el sistema durante algún intervalo de tiempo] = [Energía neta transferida en el límite del sistema por el proceso de transferencia de calor durante el mismo intervalo] [Energía neta transferida fuera del límite del sistema por el trabajo durante el mismo intervalo]
En la ecuación anterior, la energía del sistema aumenta o disminuye en una cantidad igual a la energía neta transferida a través de la frontera y puede expresarse como
| Energía total (E2 E1) o E | Q W |
| KE + PE + U | Q W |
| Balance energético en forma diferencial (dE) Donde dE es propiedad | El calor y el trabajo de Q W no son propiedad |
| dE/dt | [Q /dt W/dt] |
En la ecuación anterior, la transferencia de energía a través de los límites da como resultado un cambio en una o más formas macroscópicas de energía como KE, PE y la energía interna (U).
El equilibrio energético con respecto al tiempo se expresa como:
[Tasa de cambio de la energía contenida en el sistema en el tiempo t] = [Tasa neta de transferencia de energía a través de la transferencia de calor en el tiempo t] [Tasa neta de transferencia de energía a través del trabajo en el tiempo t]
Ya que la tasa de cambio de energía en el tiempo viene dada por,![]()
![]()
Por lo tanto,
| dE/dt | [Q /dt W/dt] |
| [dKE/dt + dPE/dt + dU/dt] | [Q /dt W/dt] |
