Ciclo de Carnot
El El ciclo de Carnot es un ciclo termodinámico que se conoce por la mejor eficiencia posible. El ciclo Carnot cambia la energía disponible en forma de calor para producir procesos útiles reversibles-adiabáticos (isótropos) y otros procesos. La eficiencia del motor de Carnot es uno menos la relación entre la temperatura del depósito térmico caliente y la temperatura del depósito frío. El ciclo Carnot es conocido por establecer el punto de referencia de eficiencia más alto que cualquier ciclo o motor puede alcanzar.
El trabajo se realiza con el fluido de trabajo durante la primera parte del ciclo y el trabajo se realiza con el fluido de trabajo durante la segunda parte del ciclo. La diferencia entre los dos es el trabajo neto realizado.
La eficiencia del ciclo puede maximizarse utilizando los procesos que requieren menos trabajo y obtener el máximo rendimiento utilizando los procesos reversibles. Prácticamente, los ciclos reversibles no pueden lograrse debido a la irreversibilidad asociada a cada proceso que no puede ser eliminado. Los refrigeradores y las máquinas de calor que funcionan en ciclos reversibles se consideran modelos para comparar las máquinas de calor y los refrigeradores reales. En el desarrollo del ciclo real, el ciclo reversible sirve como punto de partida y se modifica para cumplir el requisito.
El El ciclo de Carnot se compone de cuatro procesos reversibles (2 nos. reversibles-isotérmicos y 2 nos. reversibles-adiabáticos) son los siguientes: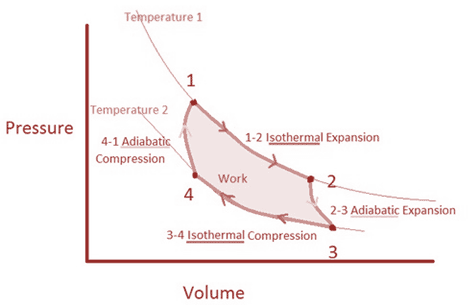

El Ciclo de Carnot se demuestra a continuación a través del ejemplo pertinente del pistón:
PASO 12
(Expansión isotérmica reversible, Th = Constante)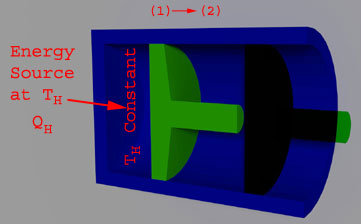

TH es la temperatura inicial del gas y también la temperatura del depósito, está en estrecho contacto con la culata. La temperatura del gas desciende cuando el gas se expande y la misma se mantiene constante transfiriendo calor infinitesimal (dT) del depósito al gas.
La cantidad de calor transferida durante el proceso al gas es Qh
PASO 2 3
(La caída de la temperatura de expansión adiabática reversible de TH a TL)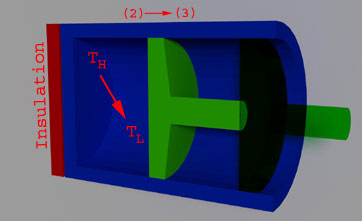

El sistema se vuelve adiabático cuando el depósito de calor es reemplazado por el aislamiento. Durante este proceso, la temperatura del gas cae a Tl de Th. Este proceso se denomina reversible y adiabático (obsérvese que termodinámica de ingeniería tiene una definición específica para los sistemas y procesos).
PASO 3 4
(Compresión isotérmica reversible, Tl = constante)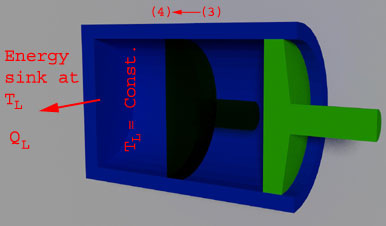

En la etapa 3, el disipador de calor reemplazó el aislamiento de la cabeza del cilindro a la temperatura Tl. Cuando la fuerza externa empuja el pistón hacia adentro para hacer el trabajo en el gas, entonces la temperatura del gas aumenta. Pero la temperatura del gas se mantiene constante rechazando el calor al fregadero. La cantidad de calor rechazada durante el proceso es Ql.
PASO 4 1
(Los aumentos de temperatura de compresión adiabática reversible de Tl a Th)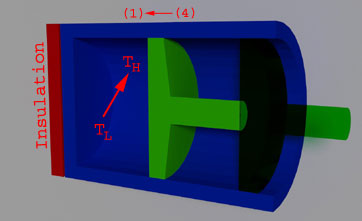

El sumidero de energía se reemplaza con aislamiento y la temperatura del gas aumenta de Tl a Th durante el proceso de compresión.
Trabajo en red realizado
El trabajo realizado por el gas durante el proceso de expansión es el área que se da bajo la curva 1-2-3.
El trabajo realizado en el gas durante el proceso de compresión es el área dada bajo la curva 3-4-1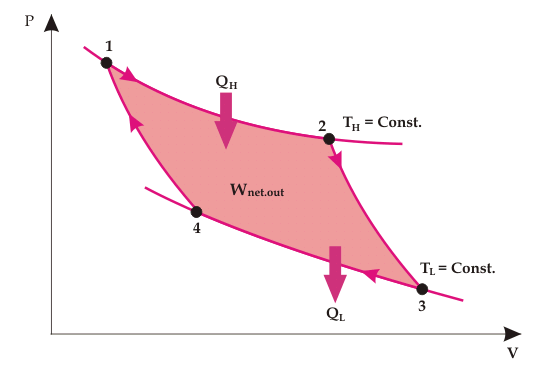

Por lo tanto, el trabajo neto realizado está dado por el área bajo el camino 1-2-3-4-1.
Importancia del ciclo de Carnot
La eficiencia del motor de calor depende de la temperatura máxima y mínima del ciclo:
Carnot afirma que la eficiencia de la máquina de calor es independiente del tipo de fluido y sólo depende de las temperaturas máximas y mínimas durante el ciclo. Por lo tanto, la eficiencia de la máquina de calor es mayor cuando funciona en super-caliente vapor la temperatura.
El ciclo de Carnot y la segunda ley de la termodinámica:
El ciclo de Carnot demostró claramente el hecho de que el calor se absorbe de la fuente de alta temperatura llamada depósito y el calor es rechazado para hundirse. Este hecho se convierte en la base de la segunda ley de la termodinámica. Pero se requiere trabajo externo para mover el calor en la dirección opuesta.
Invertir el ciclo de Carnot
El ciclo de Carnot es un ciclo reversible, y se convierte en el ciclo de refrigeración de Carnot cuando el proceso se invierte. La dirección del calor y las interacciones de trabajo se invierten totalmente, por lo que
Así,
- El calor absorbido del depósito de baja temperatura es Ql
- El calor rechazado a un depósito de alta temperatura es Qh
- El trabajo realizado es Wnet-in
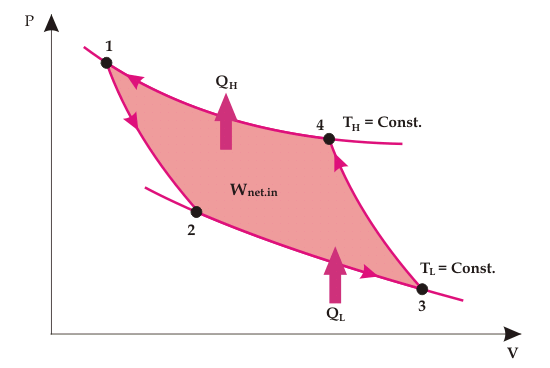

Invirtió el ciclo de Carnot es la misma que la de los convencionales Ciclo de Carnot excepto por la dirección de los procesos.
Historia del ciclo de Carnot
El ciclo Carnot se llama así por N. L. Sadi Carnot que lo inventó en 1824. Sadi Carnot es conocido como el fundador de la termodinámica por descubrir la relación entre el calor y el trabajo. Carnot fue uno de los primeros en darse cuenta de que el calor es esencialmente trabajo en forma adiferente.