Con el desarrollo de Efecto fotoeléctricoEl efecto Cromptons y El modelo de átomo de Bohrsla idea de que la luz o, de hecho, las radiaciones en general, están compuestas por partículas o Quanta estaba ganando una amplia popularidad.
Sin embargo, el muy establecido Principio Huygens y los resultados de los experimentos de doble rendija de los Youngs dejaron muy claro que la luz era una onda y no una partícula de flujo.
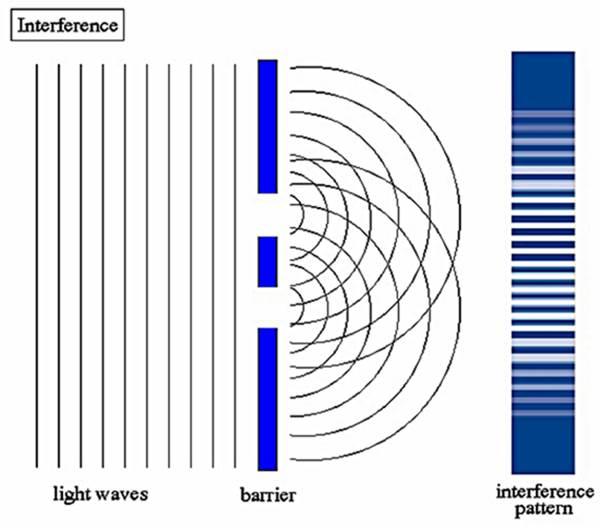

El sorprendente patrón de interferencia observado al pasar la luz a través de las dobles rendijas fue definitivamente el resultado de la naturaleza ondulatoria de la luz. Esto dio lugar nuevamente a la controversia sobre la naturaleza de la luz. En 1704 Newton también había sugerido la naturaleza de partícula de la luz por su teoría corpuscular.
Ninguna de las dos teorías era lo suficientemente adecuada para explicar todos los fenómenos asociados a la luz. Así, los científicos comenzaron a concluir que la luz tiene naturaleza de onda y de partícula. En 1924, un físico francés, Louis de Broglie, presentó una teoría. Sugirió que todas las partículas de este universo están asociadas con la naturaleza de onda también, es decir, todo en este mundo ya sea un pequeño fotón o un elefante gigante, todo tiene una onda asociada consigo mismo, es una materia diferente que la naturaleza de onda es notable o no. Asignó una longitud de onda a cada materia con masa m y momento p como![]()
![]()
Donde, h es la constante de Planck y p = mv, v es la velocidad del cuerpo.
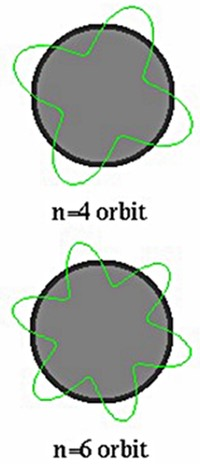
Por lo tanto, debido a la enorme masa de un elefante tiene un impulso muy significativo y por lo tanto una longitud de onda muy pequeña, que no podemos notar. Sin embargo, las pequeñas partículas como los electrones, etc. tienen una masa muy pequeña y por lo tanto una longitud de onda o naturaleza de onda muy notable. Esta teoría de de Broglie también nos ayuda a explicar la discreta existencia de las órbitas en el modelo de átomo de Bohrs. Un electrón existirá en una órbita si su longitud es igual a un múltiplo integral de su longitud de onda natural, si es incapaz de completar su longitud de onda entonces esa órbita no existirá.

El desarrollo de Davisson y Germer de la difracción de electrones de un cristal y un patrón de interferencia similar obtenido después de bombardear una doble rendija con electrones había fortalecido la teoría de ondas de materia de de Broglies o la la dualidad onda-partícula teoría.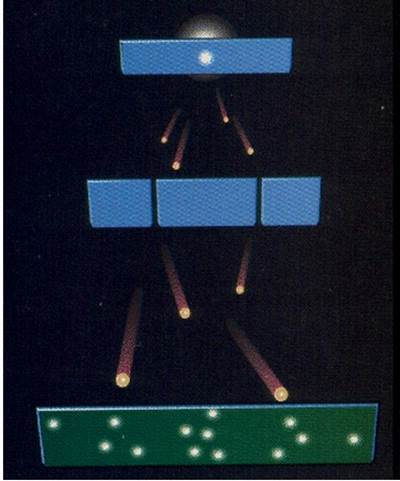

Efecto Compton
En el efecto fotoeléctrico, la luz golpea un metal en forma de un haz de partículas llamadas fotones. La energía de un fotón contribuye a la función de trabajo de un electrón, así como proporciona la energía cinética a ese electrón emitido. Estos fotones son la partícula como el comportamiento de la onda de luz. Sir Albert Einstein propuso que la luz es el efecto colectivo de un gran número de paquetes de energía llamados fotones donde cada fotón contiene energía de hf. Donde h es la constante de Planck y f es la frecuencia de la luz. Este es un comportamiento de la onda de luz como una partícula. El comportamiento de la onda de luz o de otra onda electromagnética como una partícula puede ser explicado por El efecto Compton.
En este experimento, un haz de rayos X de frecuencia fo y la longitud de ondao fue un incidente en un electrón. Después de golpear el electrón por el rayo X incidente se encuentra que tanto el electrón como el rayo X incidente están dispersos en dos ángulos diferentes con respecto al eje del rayo X incidente. Esta colisión obedece al principio de la conversación de la energía, al igual que la colisión de las partículas newtonianas. Se descubrió que después de la colisión el electrón se acelera en una dirección particular y el rayo X incidente se difracta en otra dirección y también se observó que el rayo difractado tiene una frecuencia y una longitud de onda diferentes a las del rayo X incidente. Como la energía del fotón varía con la frecuencia, puede concluirse que el rayo X incidente pierde una energía durante las colisiones y la frecuencia del rayo difractado es siempre menor que la del rayo X incidente. Esta energía perdida del fotón de rayos X contribuye a la energía cinética para el movimiento del electrón. Esta colisión de los rayos X o de su fotón y su electrón es como la de las partículas newtonianas, como las bolas de billar.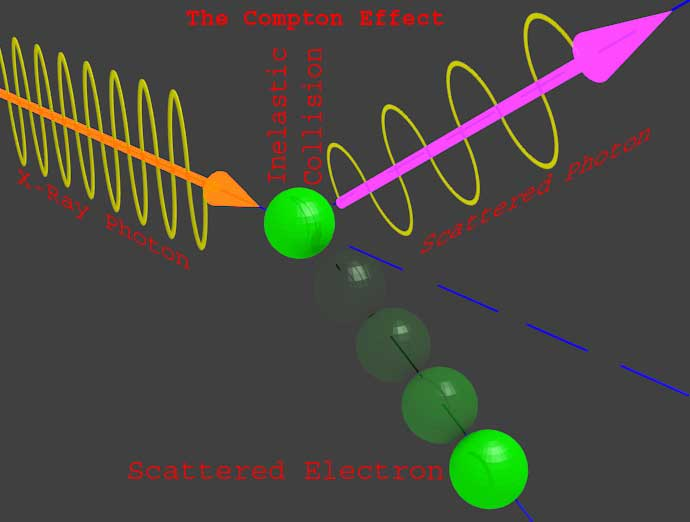

La energía del fotón está dada por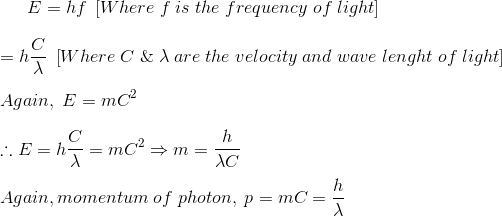
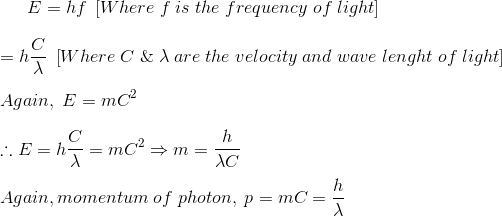
Por lo tanto, el impulso del fotón puede probarse como![]()
![]()
Que puede ser escrito como,![]()
![]()
De la ecuación (1) se puede concluir que una onda electromagnética con longitud de onda tendrá el fotón con momento p.
De la ecuación (2) se puede concluir que una partícula con momento p está asociada con la longitud de onda . Eso significa que la onda tiene características similares a las de las partículas, la partícula en movimiento también exhibe un comportamiento similar a la onda.
Como ya dijimos, esta conclusión fue sacada por primera vez por De Broglie y por lo tanto se conoce como la hipótesis de De Broglie. Como la longitud de onda de la partícula en movimiento se expresa como![]()
![]()
Donde, p es el momento, h es la constante de Planck y la longitud de onda se refiere a la longitud de onda de De Broglies. De Broglie explicó que a medida que los electrones orbitan alrededor del núcleo también tendrá el comportamiento de onda junto con sus características de partícula.
La división y el experimento Germer
La naturaleza ondulatoria del electrón puede ser probada y establecida de muchas maneras diferentes, pero el experimento más popular es el de Divission and Germer en el año 1927. En este experimento utilizaron un haz de electrones acelerados que normalmente golpea la superficie de un bloque de níquel. Observaron el patrón de electrones dispersos después de golpear el bloque de níquel. Utilizaron un monitor de densidad de electrones para este propósito. Aunque se esperaba que el electrón se dispersara después de la colisión en un ángulo diferente con respecto al eje del haz de electrones incidente, pero en el experimento real se encontró que la densidad de los electrones dispersados estaba más en determinados ángulos que en otros. Esta distribución angular de los electrones dispersos es muy similar a una interferencia que la de la difracción de la luz. Por lo tanto, este experimento muestra claramente la existencia de la dualidad onda-partícula de electrones. El mismo principio puede aplicarse al protón y a los neutrones también.
