Historia del SF6
SF6 o hexafluoruro de azufre Las moléculas de gas se combinan con un azufre y seis átomos de flúor. Este gas fue realizado por primera vez en el año 1900 en los laboratorios de la Facultad de Farmacia de, en París. En el año 1937, la Compañía General de Electricidad se dio cuenta por primera vez que el SF6 El gas podría ser utilizado como material aislante gaseoso. Después de la Segunda Guerra Mundial, es decir, a mediados de los años 20…th siglo, la popularidad del uso del gas hexafluoruro de azufre como material aislante en el sistema eléctrico estaba aumentando muy rápidamente. Allied Chemical Corporation y Pennsalt fueron las primeras industrias americanas que comenzaron a producir este gas comercialmente en 1948. Durante 1960, el uso de gas hexafluoruro de azufre en equipo de conmutación de alto voltaje se hizo popular. A medida que la demanda de este gas aumentaba, muchos fabricantes en Europa y América comenzaron a producir SF6 gas a gran escala, durante ese tiempo. Al principio, el gas SF6 sólo se utilizaba para el aislamiento del sistema eléctrico. Pero pronto se dio cuenta de que este gas tiene una tremenda propiedad de apagado de arco. Por lo tanto, este gas también comenzó a ser usado en interruptor de circuito… como apagado de arco medio. Mundos primero SF6 La subestación con aislamiento de gas se estableció en París en el año 1966. Los interruptores de media tensión de hexafluoruro de azufre se lanzaron al mercado a partir de 1971.
Fabricación de gas SF6
El gas SF6 se fabrica comercialmente mediante la reacción del flúor (obtenido por electrólisis) con el azufre.
 Durante el proceso de producción de este gas, otros subproductos como el SF4…SF…2, S2F2, S2F10 también se producen en pequeños porcentajes. No sólo estos subproductos, las impurezas como el aire, la humedad y el CO2 también están presentes en el gas, durante la producción. Todos estos subproductos e impurezas son filtrados en diferentes etapas de purificación para obtener el producto final puro y refinado.
Durante el proceso de producción de este gas, otros subproductos como el SF4…SF…2, S2F2, S2F10 también se producen en pequeños porcentajes. No sólo estos subproductos, las impurezas como el aire, la humedad y el CO2 también están presentes en el gas, durante la producción. Todos estos subproductos e impurezas son filtrados en diferentes etapas de purificación para obtener el producto final puro y refinado.
Propiedades químicas del gas SF6
Para examinar la química propiedades del gas SF6primero introducimos la estructura de la molécula de SF6. En esta molécula de gas, un átomo de azufre está rodeado por seis átomos de flúor.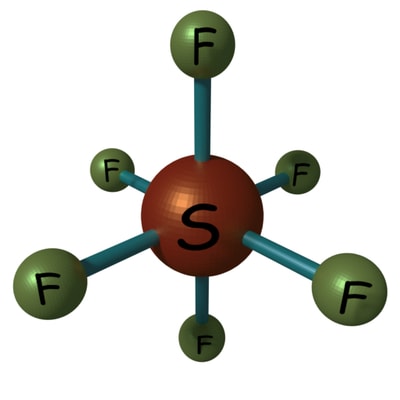

El azufre tiene un número atómico de 16. La configuración electrónica del átomo de azufre es 2, 8, 6, es decir, 1S2 2S2 2P6 3S2 3P4. El átomo de flúor tiene el número atómico 9. La configuración electrónica del flúor es 1S2 2S2 2P5. Cada átomo de azufre en SF6 La molécula crea un enlace covalente con 6 átomos de flúor. De esta manera, el átomo de azufre obtiene un total de 6 enlaces covalentes, es decir, 6 pares de electrones en su capa exterior, y cada átomo de flúor obtiene 8 electrones en su capa más exterior.
NB: Aquí podemos observar que, en el hexafluoruro de azufre, la capa externa del átomo de azufre tiene 12 electrones en lugar de 8 electrones. Eso significa que aquí el azufre no obedece a la regla general octal de estructura atómica que establece que, un estable átomo requiere 8 electrones en su capa más externa. Este no es un caso excepcional. Algunos elementos en el 3er período y más abajo pueden formar un compuesto que supera los 8 electrones en su capa más exterior. La estructura molecular de este gas se muestra a continuación,
 De esta manera, el SF6 satisface plenamente una condición estructural estable. El radio efectivo de una molécula de hexafluoruro de azufre es de 2.385 A. Esta configuración electrónica y la estructura de este gas hacen que el SF6 extremadamente estable. El gas puede ser estable sin ninguna descomposición en su estructura molecular hasta 500oC. Es altamente no inflamable. H2El O y el Cl no pueden reaccionar con este gas. Tampoco reacciona con el ácido.
De esta manera, el SF6 satisface plenamente una condición estructural estable. El radio efectivo de una molécula de hexafluoruro de azufre es de 2.385 A. Esta configuración electrónica y la estructura de este gas hacen que el SF6 extremadamente estable. El gas puede ser estable sin ninguna descomposición en su estructura molecular hasta 500oC. Es altamente no inflamable. H2El O y el Cl no pueden reaccionar con este gas. Tampoco reacciona con el ácido.
El SF6 El gas es uno de los gases más pesados. La densidad de este gas a 20oC a una presión atmosférica, es de unos 6.139 kg/m3 que es unas 5 veces más alto que el aire en las mismas condiciones. El peso molecular de este gas es de 146,06. La variación de la presión con la temperatura es lineal para hexafluoruro de azufre y es pequeño dentro de la temperatura de servicio, es decir, de 25 a + 50oC. El calor específico volumétrico de este gas también es alto. Es alrededor de 3,7 veces más que el del aire, y es por eso que este gas también tiene un tremendo efecto refrigerante en los equipos eléctricos. La conductividad térmica de este gas no es muy alta, es incluso más baja que la del aire. Aún así, es muy adecuado para el efecto de enfriamiento en interruptor de circuito…. Es porque, durante la disociación de las moléculas de hexafluoruro de azufre alrededor del arco eléctrico, estas moléculas absorben una gran cantidad de calor. Este calor se libera cuando las moléculas se reforman en la periferia del arc. Este proceso ayuda a transferir el calor de una región caliente a una región fría muy rápidamente. Por eso, este gas tiene un excelente efecto de enfriamiento a altas temperaturas, aunque la conductividad térmica del SF6 no es muy alta.
Propiedades eléctricas del SF6 Gas
SF6 El gas es altamente electronegativo. Debido a su alta electronegatividad, absorbe los electrones libres que se producen debido a la formación de arcos entre los contactos de interruptor de circuito…. La combinación de electrones libres con moléculas produce iones pesados y grandes, que tienen muy poca movilidad. Debido a la absorción de electrones libres y la baja movilidad de los iones SF6 tiene una excelente propiedad dieléctrica. La fuerza dieléctrica del gas SF6 es unas 2,5 veces mayor que la del aire.
Lista de propiedades del gas hexafluoruro de azufre
| Densidad a 20oC | 6,14 kg/m3 |
| Color del gas | incoloro |
| Peso molecular | 146.06 |
| Conductividad térmica | 0.0136 w/mK |
| Temperatura crítica | 45.55oC |
| Densidad crítica | 730 Kg/m3 |
| Presión crítica | 3,78 MPa |
| Velocidad del sonido en SF6 | 136 m/s. Es 3 veces menos que en el aire |
| Índice de refracción | 1.000783 |
| Calor de formación | -1221.66 Kg/mol |
| Calor específico | 96,6 j/mole K |
| El campo de ruptura relativo a la presión | 89 V/m Pa |
| La constante dieléctrica relativa a 25oC y 1 barra absoluta | 1.00204 |
| Factor de disipación o bronceado a 25oC y 1 barra absoluta | <2 × 10-7 |