La combustión es una reacción química rápida entre el combustible y el oxígeno. Cuando los elementos combustibles del combustible se combinan con el O2…la energía térmica sale. Durante la combustión, los elementos combustibles como el carbono, el azufre, el hidrógeno, etc. se combinan con el oxígeno y producen los óxidos correspondientes. La fuente de oxígeno en la combustión del combustible es el aire. En volumen hay un 21% de oxígeno presente en el aire y en peso es el 23,2%. Aunque hay un 79% (en volumen) de nitrógeno en el aire, no juega ningún papel en la combustión.
En realidad el nitrógeno lleva el calor producido durante la combustión a caldera de vapor pila. Según la teoría de la combustión la cantidad de aire necesaria para la combustión es la que proporciona suficiente O2 para oxidar completamente los elementos combustibles del combustible. Esta cantidad de aire se conoce normalmente como necesidad de aire estomacal.
Esta cantidad de aire depende de la naturaleza del combustible. Los requerimientos de aire estenoquímico para los diferentes combustibles se obtienen mediante el análisis del combustible y se dan en forma tabular a continuación,

| Combustible | Masa de aire estentóreo / masa unitaria de combustible |
| Carbón bituminoso | 11.18 |
| Carbón Anttiasita | 10.7 |
| Coca-Cola | 9.8 |
| Liquite | 7.5 |
| Turba | 5.7 |
| Fuelóleo residual | 13.85 |
| Destilar Fuel Oil (Gas Oil) | 14.48 |
| Gas natural (base de metano) | 17.3 |
Combustión del carbón
Para tener suficiente aire,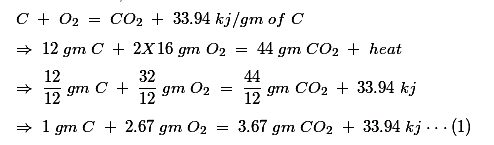
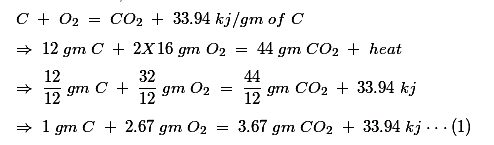
Ya hemos dicho que en cuanto a la masa hay un 23,2% de O2 se presenta en el aire. Por lo tanto, la cantidad de aire necesaria para proporcionar 2,67 gm de O2 es![]()
![]()
Según la teoría de la combustión ideal, después de la combustión de un gm de carbono (C), el producto de la combustión contiene sólo 3,67 gm de CO2 y 
Combustión de carbón para el aire insuficiente
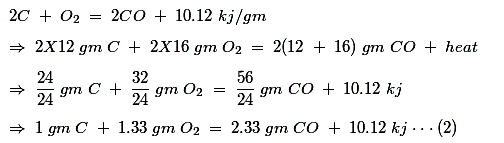
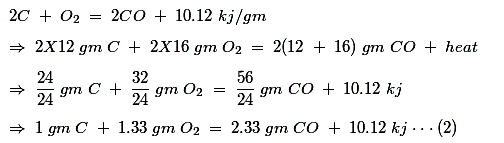
Por peso, el requerimiento de aire para proveer tanto O2 es![]()
![]()
Después de la combustión de un gm de carbono (C), el producto de la combustión contiene sólo 2,33 gm de CO y 
De las ecuaciones (1) y (2) se desprende claramente que debido a la insuficiente combustión del aire, la pérdida de calor durante 1 gm de combustión de carbón es 
Combustión de azufre
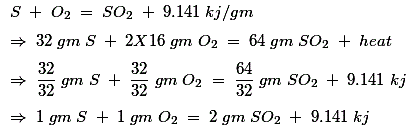
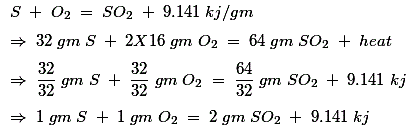
Por lo tanto, el aire requerido para la combustión de 1 gm de azufre, es![]()
![]()
Así, el producto de la combustión, después de completar 1 gm de combustión de azufre, contiene 2 gm de SO2 y 
Combustión de Hidrógeno
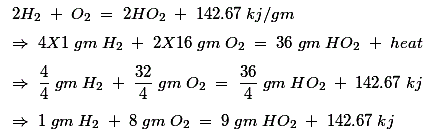
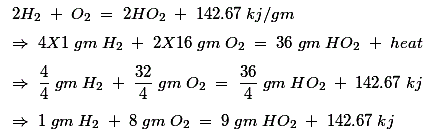
De la teoría de la combustión de C, S y H2 se encuentra que se requieren 2,67 gm de oxígeno para la combustión de 1 gm de carbono, lo que implica que se requieren 2,67 C gm de oxígeno para la combustión de C gm de carbono, 1 gm de oxígeno para la combustión de 1 gm de azufre, lo que implica que se requieren S gm de oxígeno para la combustión de S gm de azufre y 8 gm de oxígeno para la combustión de 1 gm de hidrógeno, lo que implica que se requieren 8H gm de oxígeno para la combustión de H gm de hidrógeno.
Por lo tanto, 1 gm de carbón (combustible) que contiene C gm de carbono, S gm de azufre y H gm de hidrógeno, requiere (2,67 C + S + 8 H) gm de oxígeno para una combustión eficiente.
El propio combustible puede contener cierta cantidad de oxígeno en forma de diferentes compuestos y también participa en la combustión. Si O es el peso original del oxígeno presente en 1 gm de combustible, la necesidad neta de oxígeno para una suficiente combustión de carbón es (2,67 C + S + 8 H O) gm. Para ello la cantidad de aire requerida es![]()
![]()
Este análisis antes mencionado se denomina análisis del carbón para la combustión.
Antes de que pueda tener lugar una combustión eficiente, deben cumplirse varios requisitos básicos, los más importantes de los cuales son
- La combustión debe hacerse con suficiente oxígeno.
- Debe haber suficiente turbulencia para promover la mezcla de combustible y oxígeno.
Contenido de carbón en el análisis de proximidad
Humedad = 8 %, material volátil = 20 a 25 %, carbono fijo = 40 %, cenizas = 30 %. Temperatura de combustión de los carbones fijos = 900oC. El componente básico de la ceniza es Si, Al y otros. Ahora la temperatura de fusión del Si es de 1200oC.
Si la temperatura del horno se eleva por encima de 1100oC entonces el Si será fundido y depositado en los tubos, como escoria, causando una transferencia de calor inapropiada.
Ahora para diluir la temperatura se requiere un exceso de aire y una combustión completa.
Ahora, el material volátil juega un papel importante en la combustión. Menos la llama del material volátil será alta, lo que puede ser una oportunidad para el impacto de la llama de la bobina S/H.
Para cumplir con el punto algunos pasos prácticos a tomar. En la práctica siempre es necesario suministrar más aire al sistema de combustión del que se requiere teóricamente. Razón de ese proceso de mezcla de aire y combustible en cualquier sistema de combustión, ya que no es posible asegurar una mezcla completa e íntima del combustible con el oxígeno necesario en el punto de inyección. Por lo tanto, se requiere un poco de aire en exceso para una combustión adecuada a un mínimo razonable de potencia, pérdida de chimenea y carbón no quemado en cenizas.
Generalmente se permite un 20% de exceso de aire.
| % de exceso de aire | Carbono no quemado en la ceniza | C.V. Liberado en el horno | Pérdida de gas no quemado |
| 0 % | 10 % | 75 % | CO2, O2, N2, H2O, CO, CH4(15 %) |
| 15 % | 2 % | 97 % | CO2, O2, N2, H2, CO(1 %) |
| 100 % | 0.5 % | 99.5 % | CO2, O2, N2 |
El tercer proceso no es satisfactorio para la potencia extra del ventilador y transmite una enorme cantidad de calor.
Las partículas de carbón deben ser de al menos 74 micrones en 200 mallas. Así que se requiere un pulverizador para
- Mejor utilidad del carbón
- Ahorro de tiempo.
Se producen principalmente tres pérdidas durante la combustión del carbón,
- Pérdida de gas no quemado
- Pérdida de gas seco de combustión
- Combustible en la pérdida de ceniza.
Pérdida de gas no quemado
Recuerde que la pérdida de gas no quemado es principalmente el resultado de quemar el carbono en monóxido de carbono en lugar de dióxido de carbono. Se ve que la liberación de calor en la reacción del CO es un tercio de la del CO2 reacción. Así que un suministro adecuado de oxígeno o de aire en exceso reducirá rápidamente esta pérdida a cero.
Pérdida de gas de combustión seca
Otra pérdida de calor es la debida a los gases de combustión secos. A menudo se conoce como la pérdida de la pila. Si se admite más exceso de aire, esta pérdida aumenta.
Combustible en la pérdida de ceniza
Esta pérdida es muy alta cuando hay poco o ningún exceso de aire porque la mezcla de material combustible y oxígeno es muy pobre. A medida que aumenta la cantidad de aire, la pérdida disminuye rápidamente. Sin embargo, no llega a cero porque la pérdida depende de dos factores: en primer lugar, de la mezcla de aire y carbón y, en segundo lugar, de la finura del grano de carbón pulverizado. Un grano más fino de carbón pulverizado ayuda a completar la combustión más perfectamente y resulta menos combustible en la pérdida de ceniza. En la práctica, sin embargo, se llega a una etapa en la que no vale la pena moler el carbón más fino porque costará más molerlo que la liberación de calor adicional. Prácticamente la pérdida no llega a cero. Generalmente un carbón de alta volatilidad es triturado hasta que el 75 % de su volumen pasa por una malla 200, mientras que un carbón de baja volatilidad es triturado hasta que el 80 % pasa por una malla similar.
La pérdida es menor a medida que se añade el exceso de aire, alcanza un mínimo y luego aumenta a medida que se añade aún más exceso de aire. Por lo tanto, sólo hay una cantidad de aire en exceso que dará una menor pérdida para la combustión de un combustible en particular. Para el carbón bituminoso el 15,5% de exceso de aire es el requisito óptimo para la combustión del carbón.