Célula Daniell es la versión modificada de Célula Voltaica. El inconveniente de la polarización de Célula Voltaica es superado en un Célula Daniell y puede considerarse como una versión mejorada de la Célula Voltaica. Constructionwise Célula Daniell es bastante simple.
La construcción de la Célula Daniell
Consiste en un recipiente de cobre lleno de una solución concentrada de sulfato de cobre. Dentro del recipiente, hay una olla cilíndrica porosa llena de ácido sulfúrico diluido, sumergida en la solución concentrada de sulfato de cobre. Una varilla de amalgama de zinc está sumergida en el ácido sulfúrico diluido en un pote poroso. Según la propiedad del electrolito diluido, el ácido sulfúrico en su forma diluida existe con iones de hidrógeno positivos e iconos de sulfato negativos. Los iones sulfato entran en contacto con la varilla de zinc liberan electrones a la varilla y producen sulfato de zinc a través de la reacción de oxidación. Como resultado, la varilla de zinc se carga negativamente y se comporta como un cátodo.
Los iones de hidrógeno positivos pueden atravesar la pared porosa de la olla y entrar en la solución de sulfato de cobre donde se unen con los iones de sulfato de cobre electrolítico y forman ácido sulfúrico. Los iones de cobre positivos del electrolito de sulfato de cobre entran en contacto con la pared interna del recipiente de cobre donde toman los electrones por reducción y se convierten en átomos de cobre y se depositan en la pared.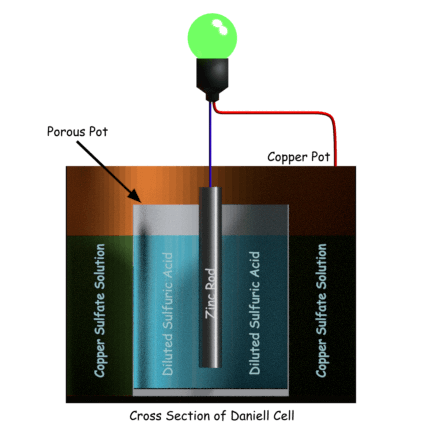

El trabajo de la Célula Daniell
Expliquemos el principio de funcionamiento de la célula paso a paso para una mejor comprensión.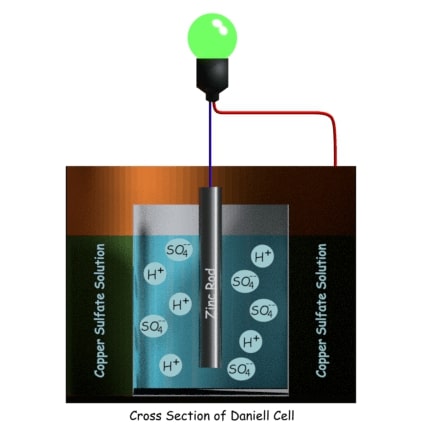

En la solución de ácido sulfúrico diluido hay H+ y SO4 iones.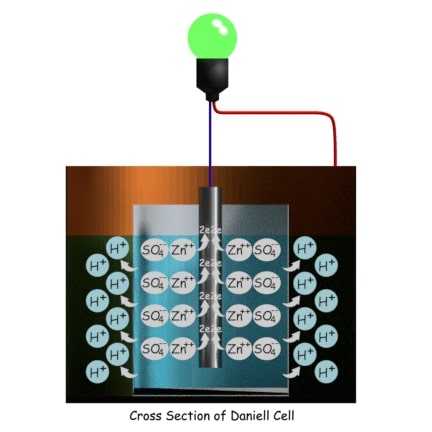

La H+ los iones salen a la solución de sulfato de cobre a través de la pared de la olla porosa. Los iones sulfato del ácido sulfúrico diluido reaccionan con la varilla de zinc donde el Zn++ los iones se unen con el SO4— iones y forman sulfato de zinc (ZnSO4). Durante esta reacción de oxidación, cada átomo de zinc deja dos electrones en la varilla de zinc. Por lo tanto, la varilla de zinc se carga negativamente, lo que significa que se comporta como el cátodo de la batería.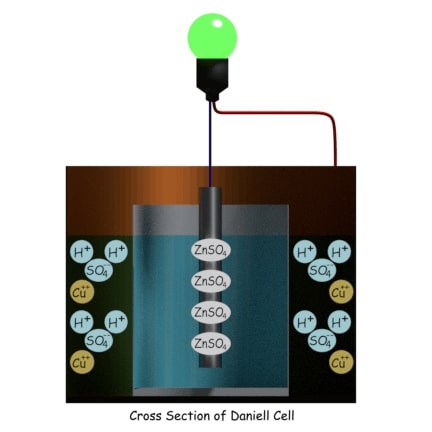

Los iones de hidrógeno (H+) en la solución de sulfato de cobre en forma de ácido sulfúrico (H2SO4) y los iones de cobre (Cu++) llegan a la pared del contenedor de cobre exterior.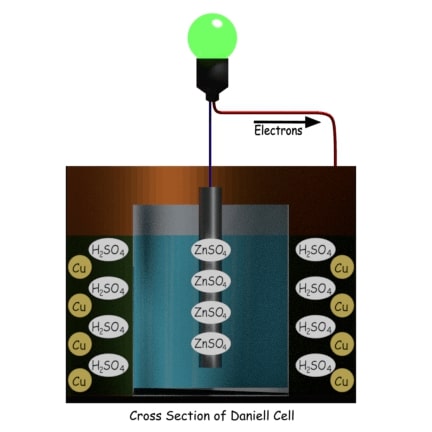

Los iones de cobre se depositan en la pared del contenedor de cobre como metal de cobre tomando electrones del contenedor. Como resultado, el contenedor de cobre se carga positivamente, lo que significa que este contenedor es el ánodo de la Célula Daniell. Ahora bien, si conectamos una carga externa entre la varilla de zinc central y la pared del contenedor de cobre periférico, los electrones empiezan a fluir de la varilla de zinc al contenedor de cobre.
En Célula Daniellpodemos evitar el inconveniente de la polarización, que es el principal inconveniente de Célula Voltaica. Como el gas de hidrógeno no se deposita en el ánodo porque forma ácido sulfúrico antes de llegar al ánodo (pared del contenedor de cobre), no se formará ninguna capa de hidrógeno en el ánodo para obstruir la reacción de reducción.