Un simple célula voltaica se hace sumergiendo una placa de zinc y una de cobre en una solución de ácido sulfúrico diluido en agua. Como se muestra en la figura, si la placa de cobre y la placa de zinc están conectadas externamente con una carga eléctrica, un La corriente eléctrica comienza a fluir de una placa de cobre a otra de zinc a través de la carga. Eso significa que hay algunos diferencia de potencial eléctrico desarrollado entre la placa de cobre y la de zinc. A medida que la corriente fluye del cobre al zinc, es obvio que la placa de cobre se carga positivamente y la de zinc se carga negativamente.
Célula Voltaica funcionando
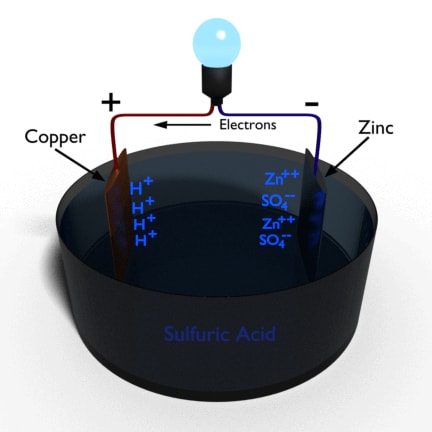

El principio de funcionamiento de la célula voltaica depende del principio de que, siempre que dos metales distintos se sumergen en una solución electrolítica, el metal más reactivo tendrá tendencia a disolverse en el electrolito como iones metálicos positivos, dejando electrones en la placa metálica. Este fenómeno hace que la placa metálica más reactiva tenga una carga negativa.
El metal menos reactivo atraerá los iones positivos presentes en el electrolito, y por lo tanto estos iones positivos se depositan en la placa haciendo que la placa se cargue positivamente. Aquí en este caso de simple célula voltaicael zinc sale en la solución de ácido sulfúrico como un ión positivo y luego reacciona con el SO negativo4 de la solución y forma sulfato de zinc (ZnSO4). Como el cobre es un metal menos reactivo, los iones de hidrógeno positivos de la solución de ácido sulfúrico tienen tendencia a depositarse en la placa de cobre. Más iones de zinc que salen en la solución significa que más electrones salen en la placa de zinc. Estos electrones pasan entonces a través del conductor externo conectado entre las placas de zinc y cobre.


Al llegar a la placa de cobre, estos electrones se combinan con los átomos de hidrógeno depositados en la placa y forman átomos de hidrógeno neutros. Estos átomos luego se combinan en pares para formar moléculas de gas de hidrógeno y el gas finalmente sube a lo largo de la placa de cobre en forma de burbujas de hidrógeno. La acción química que tiene lugar dentro de la célula voltaica es la siguiente,
Sin embargo, esta acción se detiene cuando el potencial de contacto entre el Zn y el ácido sulfúrico diluido alcanza el valor de 0,62 voltios. Durante el funcionamiento de una celda voltaica, el zinc tardío se encuentra a un potencial más bajo con respecto a la película de solución adyacente, como se muestra en la figura siguiente.
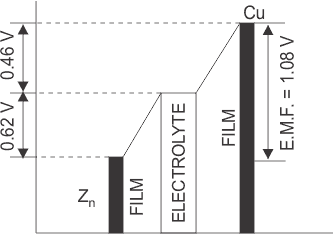

De manera similar, cuando la placa de Cu se pone en contacto con el electrolito, entonces los iones de hidrógeno positivos de la solución tienen la tendencia a depositarse en ella hasta que su potencial se eleva casi a 0,46 V por encima de esa solución. Por lo tanto, el diferencia de potencial eléctrico desarrollado en una célula voltaica es de 0,62 ( 0,46) = 1,08 Voltios.
En un célula voltaica simple hay principalmente dos inconvenientes, denominados polarización y la acción local.
Polarización de la Célula Voltaica
Se observa que en esta célula, la corriente se reduce gradualmente y después de cierto tiempo de su funcionamiento, la corriente puede cesar por completo. Esta disminución de la corriente se debe a la deposición de hidrógeno en la placa de cobre. Aunque el hidrógeno sale de la célula en forma de burbujas, todavía hay una formación de una fina capa de hidrógeno en la superficie de la placa. Esta capa actúa como un aislamiento eléctrico, aumentando así la resistencia de la célula. Debido a esta capa aislante, los demás iones de hidrógeno no pueden obtener electrones de la placa de cobre y se depositan en forma de iones. Esta capa de iones de hidrógeno positivos en la placa de cobre ejerce una fuerza repulsiva sobre otros iones de hidrógeno que se acercan a la placa de cobre. Por lo tanto, la corriente se reduce. Este fenómeno se conoce como polarización.
Acción local de la Célula Voltaica
Se ha descubierto que incluso cuando el célula voltaica no suministra ninguna corriente, el zinc se disuelve continuamente en el electrolito. Esto se debe al hecho de que algunos rastros de impurezas como el hierro y el plomo en el zinc comercial forman diminutas células locales que son cortocircuitadas por el cuerpo principal del zinc. La acción de estas células parásitas no puede ser controlada de modo que hay algún desperdicio de zinc. Este fenómeno se conoce como acción local.