Una pila funciona en la reacción de oxidación y reducción de un electrolito con metales. Cuando dos sustancias metálicas diferentes, llamadas electrodos, se colocan en un electrolito diluido, la reacción de oxidación y reducción tiene lugar en los electrodos, respectivamente, dependiendo de la afinidad electrónica del metal de los electrodos. Como resultado de la reacción de oxidación, un electrodo se carga negativamente llamado cátodo y debido a la reacción de reducción, otro electrodo se carga positivamente llamado ánodo. El cátodo forma el terminal negativo mientras que el ánodo forma el terminal positivo de una batería. Para entender el principio básico de la batería adecuadamente, primero, deberíamos tener algún concepto básico de afinidad de electrolitos y electrones. En realidad, cuando dos metales diferentes se sumergen en un electrolito, habrá una diferencia de potencial producido entre estos metales. Se ha descubierto que, cuando se añaden algunos compuestos específicos al agua, se disuelven y producen iones negativos y positivos. Este tipo de compuesto se llama electrolito. Los ejemplos populares de electrolitos son casi todos los tipos de sales, ácidos y bases, etc. La energía liberada durante la aceptación de un electrón por un átomo neutro se conoce como afinidad al electrón. Como el estructura atómica para diferentes materiales son diferentes, la afinidad de los electrones de los diferentes materiales será diferente.
Si dos tipos diferentes de metales se sumergen en la misma solución electrolítica, uno de ellos ganará electrones y el otro los liberará. Qué metal (o compuesto metálico) ganará electrones y cuál perderá electrones, depende de la afinidad de estos metales con los electrones. El metal con baja afinidad a los electrones ganará electrones de los iones negativos de la solución electrolítica. Por otro lado, el metal con alta afinidad a los electrones liberará electrones y estos electrones salen a la solución electrolítica y se añaden a los iones positivos de la solución. De esta manera, uno de estos metales gana electrones y otro los pierde. Como resultado, habrá una diferencia en la concentración de electrones entre estos dos metales. Esta diferencia en la concentración de electrones causa una diferencia de potencial eléctrico desarrollado entre los metales. Este diferencia de potencial eléctrico o emf puede ser utilizado como fuente de voltaje en cualquier electrónica o circuito eléctrico. Este es un general y básico principio de la batería y esto es cómo funciona una batería.
Todas las celdas de las baterías se basan sólo en este principio básico. Vamos a discutir uno por uno. Como dijimos antes, Alessandro Volta desarrolló la primera celda de batería, y esta celda es conocida popularmente como la simple célula voltaica. Este tipo de célula simple puede ser creada muy fácilmente. Tome un recipiente y llénelo con ácido sulfúrico diluido como electrolito. Ahora sumergimos una varilla de zinc y otra de cobre en la solución y las conectamos externamente por medio de una carga eléctrica. Ahora su simple célula voltaica se ha completado. La corriente comenzará a fluir a través de la carga externa. 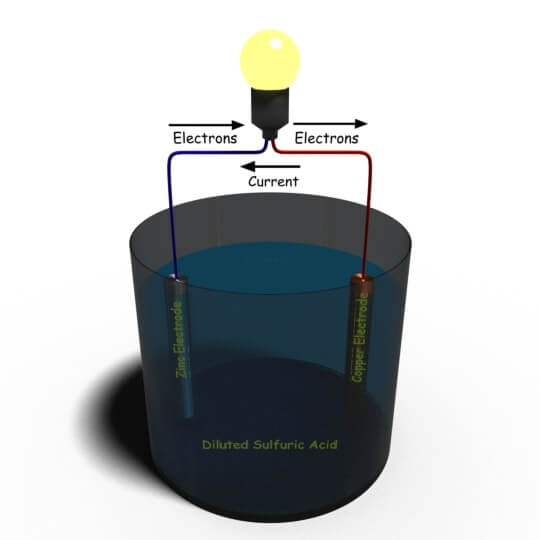

El zinc en un ácido sulfúrico diluido cede electrones como se indica a continuación:

Estos Zn + + los iones pasan al electrolito, y cada uno de los iones de Zn + + Los iones dejan dos electrones en la varilla. Como resultado de la reacción de oxidación anterior, el electrodo de zinc queda cargado negativamente y por lo tanto actúa como un cátodo. En consecuencia, la concentración de Zn + + iones cerca del cátodo en el electrolito aumenta.
En cuanto a la propiedad del electrolito, el ácido sulfúrico diluido y el agua ya se han disociado en iones de hidronio positivos e iones de sulfato negativos como se indica a continuación:

Debido a la alta concentración de Zn+ + iones cerca del cátodo, el H3O+ los iones se repelen hacia el electrodo de cobre y se descargan absorbiendo electrones de los átomos de la varilla de cobre. La siguiente reacción tiene lugar en el ánodo:

Como resultado de la reacción de reducción que tiene lugar en el electrodo de cobre, la varilla de cobre se carga positivamente y por lo tanto actúa como un ánodo.
Célula Daniell
El Célula Daniell consiste en un recipiente de cobre que contiene una solución de sulfato de cobre. El recipiente de cobre en sí mismo actúa como el electrodo positivo. En el recipiente de cobre se coloca una olla porosa que contiene ácido sulfúrico diluido. Una varilla de zinc amalgamada, sumergida en el ácido sulfúrico, actúa como electrodo negativo.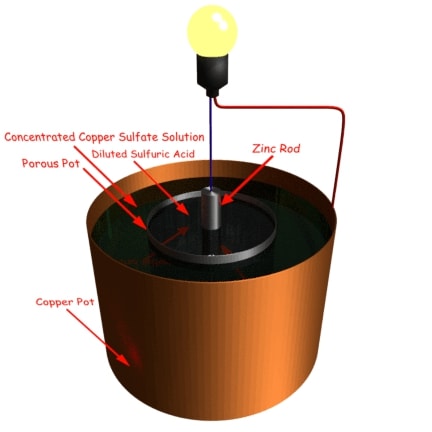

El ácido sulfúrico diluido en la olla porosa reacciona con el zinc y como resultado se elabora el hidrógeno. La reacción tiene lugar como se indica a continuación:

La formación de ZnSO4 en el pote poroso no afecta el funcionamiento de la célula hasta que los cristales de ZnSO4 se deposita. El gas de hidrógeno pasa a través de la olla porosa y reacciona con el CuSO4 solución como la que se muestra a continuación:

El cobre así formado se deposita en el recipiente de cobre.