Antes de entrar en detalles de este tema, es decir. carga y descarga de la batería primero intentaremos entender qué es la oxidación y la reducción. Porque, batería se descargan o cargan debido a reacciones de oxidación y reducción.
Para entender la teoría de la oxidación y la reducción, podemos ir directamente a un ejemplo de reacción química. Consideremos la reacción entre el zinc metálico y el cloro.

En la reacción anterior, el zinc (Zn) cede primero dos electrones y se convierte en iones positivos.

Aquí, cada átomo de cloro acepta un electrón y se convierte en un ión negativo.

Ahora, estos dos iones cargados de forma opuesta se combinan para formar, el cloruro de zinc (ZnCl2)
En esta reacción, a medida que el zinc cede electrones, se oxida y el cloro acepta electrones, por lo que se reduce.
Como cuando un átomo cede un electrón, su número de oxidación aumenta. Aquí, en nuestro ejemplo, el número de oxidación del zinc se convierte en + 2 desde 0. A medida que el número de oxidación aumenta, esta parte de la reacción se denomina reacción de oxidación. Por otra parte, cuando un átomo acepta electrones, su número de oxidación negativo aumenta, lo que significa que el número de oxidación del átomo disminuye con respecto a la referencia cero. A medida que el número de oxidación disminuye o se reduce, esta parte de la reacción se denomina reducción.
Descarga de la batería
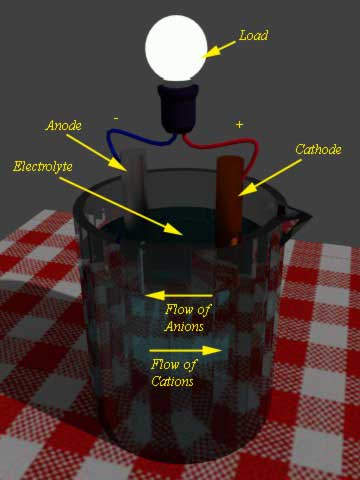

En una batería hay dos electrodos sumergidos en un electrolito. Cuando se conecta una carga externa a estos dos electrodos, comienza la reacción de oxidación en un electrodo y al mismo tiempo se produce una reducción en el otro.
El electrodo, donde tiene lugar la oxidación, el número de electrones se hace excesivo. Este electrodo se denomina electrodo negativo o ánodo.
Por otra parte, durante descarga de la bateríael otro electrodo participa en la reacción de reducción. Este electrodo se denomina cátodo. Los electrones que sobran en el ánodo, ahora fluyen al cátodo a través de la carga externa. En el cátodo estos electrones son aceptados, eso significa que el material del cátodo se involucra en la reacción de reducción.
Ahora los productos de la reacción de oxidación en el ánodo son iones o cationes positivos, que fluirán al cátodo a través del electrolito y al mismo tiempo, los productos de la reacción de reducción en el cátodo son iones o aniones negativos, que fluirán al ánodo a través del electrolito.
Tomemos un ejemplo práctico para ilustrar la descarga de la batería. Consideremos una celda de níquel-cadmio. Aquí, el cadmio es el ánodo o electrodo negativo. Durante la oxidación en el ánodo, el metal de cadmio reacciona con el OH – y libera dos electrones y se convierte en hidróxido de cadmio.

El cátodo de esta batería está hecho de oxihidróxido de níquel o simplemente de óxido de níquel. En el cátodo se produce una reacción de reducción y debido a esta reacción de reducción, el óxido de níquel se convierte en hidróxido de níquel al aceptar electrones.

Carga de la batería
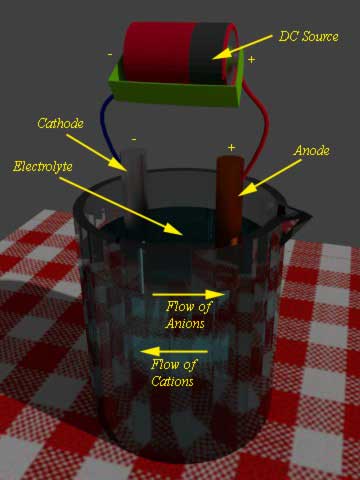

Durante carga de la batería…se aplica una fuente externa de CC a la batería. El terminal negativo de la fuente de CC se conecta a la placa negativa o al ánodo de la batería y el terminal positivo de la fuente se conecta a la placa positiva o al cátodo de la batería.
Ahora, debido a la fuente externa de DC, los electrones serán inyectados en el ánodo. La reacción de reducción tiene lugar en el ánodo en lugar de en el cátodo. En realidad, en el caso de la descarga de la batería, la reacción de reducción tiene lugar en el cátodo. Debido a esta reacción de reducción, el material del ánodo recuperará los electrones y volverá a su estado anterior cuando la batería no se haya descargado.
Como el terminal positivo de la fuente de CC está conectado al cátodo, los electrones de este electrodo serán atraídos por este terminal positivo de la fuente de CC. Como resultado, se produce una reacción de oxidación en el cátodo y el material catódico recupera su estado anterior (cuando no estaba descargado). Esta es la base general de la carga de la batería.
Ahora tomemos un ejemplo de célula de níquel-cadmio recargable. Durante carga de la bateríalos terminales negativo y positivo de la fuente de CC del cargador están conectados al electrodo negativo y positivo de la batería. Aquí en el ánodo, debido a la presencia de electrones del terminal negativo de CC, se produce una reducción debido a la cual el hidróxido de cadmio vuelve a convertirse en cadmio en fila y libera iones de hidróxido (OH–) al electrolito.

En el cátodo o electrodo positivo, debido a la oxidación, el hidróxido de níquel se convierte en oxihidróxido de níquel liberando agua en la solución electrolítica.

Durante carga de la batería…la batería secundaria vuelve a su estado original cargado y listo para una mayor descarga de la batería.
Buen artículo. Quiero aprovechar este post para hacer una consulta al experto, por si pudiese resolvérmela.
Para los ciclos de carga y descarga que mencionas ¿podría valer un regenerador de baterías (kit de cargador y descargador)? He visto que en Amperis tienen descargador de baterías y cargador todo en un pack con el fin de llevar a cabo estos ciclos y prolongar la vida útil de las baterías. El descargador de baterías Amperis sirve como analizador y descargador de baterías automático diseñado para probar la eficiencia de las baterías industriales de cualquier tipo, tensión y capacidad, además puede ser programado para descargar la batería a una corriente constante que se controla de manera precisa, ajustable de cero al valor máximo del modelo mientras se mantiene la tensión de la batería bajo control. Que opinan? Gracias!