Ionización
Se ha comprobado que cuando se añaden al agua algunos tipos particulares de sustancias, éstas se disuelven y sus moléculas se dividen en iones negativos y positivos. Este proceso de división de las moléculas en iones positivos y negativos en solución se conoce generalmente como ionización. Así que definición de ionización puede ser como sigue,
¿Qué es la ionización?
Definición de Ionización
El proceso de división de las moléculas de una sustancia en iones positivos y negativos cuando la sustancia se disuelve se conoce como ionización.
Ahora discutiremos sobre proceso de ionización en detalle.
Proceso de ionización
Para entender el proceso, consideraremos la estructura del cloruro de sodio. El cloruro de sodio es la sal común, que usamos en nuestra vida diaria. Los números atómicos de Na y Cl son 11 y 17 respectivamente. Eso significa que el átomo de sodio tiene 11 números de electrones y el átomo de cloro tiene 17 números de electrones en sus órbitas. El estructura atómica o disposición de los electrones en sus órbitas, en ambos átomos se muestran en la figura siguiente.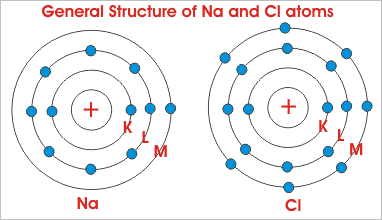

Está claro por la figura de al lado, que el átomo de Na sólo tiene un único electrón en su órbita más exterior. Mientras que el cloro contiene siete electrones en su órbita más exterior. Pero sabemos que para la estabilidad, átomos generalmente requieren ocho electrones en su órbita más externa. Por lo tanto, ambos átomos mostrados son químicamente activos. Cuando estos átomos se juntan, el átomo Na pierde sus electrones más externos, se carga positivamente y el átomo Cl gana un electrón y se carga negativamente. Así que ambos átomos adquieren ocho electrones en su órbita más externa intercambiando estos electrones. Como el átomo de Na está cargado positivamente y el átomo de Cl está cargado negativamente, la fuerza electrostática actúa entre ellos, debido a lo cual se unirán y harán una molécula de NaCl.
Ahora, de acuerdo con Ley de Coulombesla fuerza electrostática que actúa entre dos cargas opuestas se expresa como,![]()
![]()
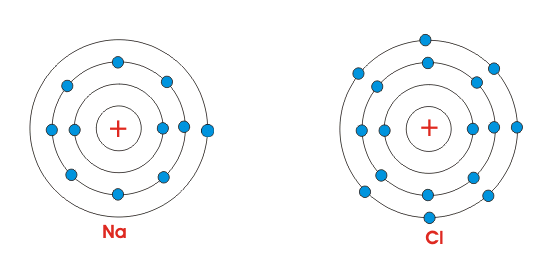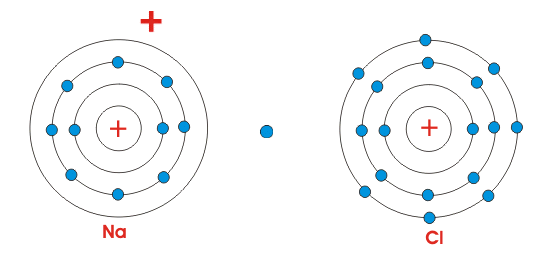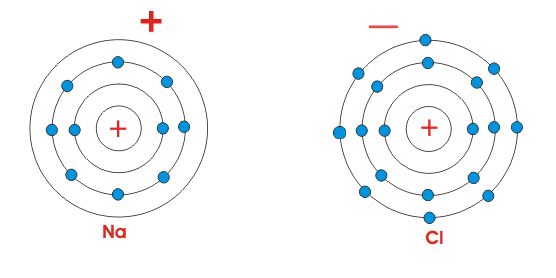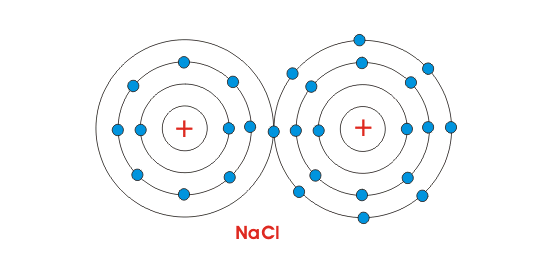

Dónde,r es la permitividad relativa del medio. Por lo tanto, es evidente que la fuerza electrostática entre dos cargas es inversamente proporcional a la permitividad relativa del medio en el que se colocan las cargas. El proceso de ionización puede explicarse fácilmente por la permitividad relativa del medio. La permitividad relativa del aire es 1.00058986 0.00000050 o 1 y la permitividad relativa del agua a 20oC es 80. Así que, en el agua la fuerza electrostática que actúa entre el Na y el Cl es 80 veces menor que la del aire. La fuerza electrostática entre el Na y el Cl se vuelve tan pequeña, que se hace difícil mantener el Na y el Cl juntos en el agua. Por eso, cuando el NaCl, es decir, el cloruro de sodio, se disuelve en el agua, sus moléculas se dividen en iones Na positivos e iones Cl negativos, incluso a temperatura ambiente e inferior. Esto es ionización de NaCl.