Electrólisis
La electrólisis es un proceso electroquímico por el cual la corriente pasa de un electrodo a otro en una solución ionizada que es un electrolito. En este proceso, los iones o cationes positivos llegan al electrodo o cátodo negativo y los iones o aniones negativos llegan al electrodo o ánodo positivo.
Antes de entender el principio de la electrólisisdeberíamos saber qué es un electrolito o definición de electrolito
Definición de electrolito
Un electrolito es una sustancia química de este tipo cuya átomos están estrechamente unidos entre sí, por enlaces iónicos, pero cuando lo disolvemos en agua, sus moléculas se dividen en iones positivos y negativos. Los iones con carga positiva se denominan cationes, mientras que los iones con carga negativa se denominan aniones. Tanto los cationes como los aniones se mueven libremente en la solución.
Principio de la electrólisis
En los enlaces iónicos, un átomo pierde sus electrones de valencia y otro átomo gana electrones. Como resultado, un átomo se convierte en un ión con carga positiva y otro átomo se convierte en un ión negativo. Debido a la carga opuesta, ambos se atraen entre sí y forman un enlace entre ellos llamado enlace iónico. En el enlace iónico, la fuerza que actúa entre los iones es la fuerza coulómbica que es inversamente proporcional a la permitividad del medio. La permitividad relativa del agua es de 80 a 20oC. Así, cuando cualquier químico de enlace iónico se disuelve en el agua, la fuerza de enlace entre los iones se hace mucho más débil y por lo tanto sus moléculas se dividen en cationes y aniones que se mueven libremente en la solución.


Ahora vamos a sumergir dos varillas de metal en la solución y aplicaremos un diferencia de potencial eléctrico entre las barras externamente por un batería.


Estas varillas parcialmente sumergidas se denominan técnicamente electrodos. El electrodo conectado con el terminal negativo de la batería se conoce como cátodo y el electrodo conectado con el terminal positivo de la batería se conoce como ánodo. Los cationes de carga positiva que se mueven libremente son atraídos por el cátodo y los aniones de carga negativa son atraídos por el ánodo. En el cátodo, los cationes positivos toman electrones del cátodo negativo y en el ánodo, los aniones negativos dan electrones al ánodo positivo. Para tomar y dar continuamente electrones en el cátodo y el ánodo respectivamente, debe haber un flujo de electrones en el circuito externo del electrolítico. Eso significa, actual continúa circulando alrededor del bucle cerrado creado por la batería, el electrolítico y los electrodos. Este es el más básico principio de la electrólisis.
La electrólisis del sulfato de cobre
Siempre que el sulfato de cobre o el CuSO4 se añade al agua, se disuelve en el agua. Como CuSO4 es un electrolito, se divide en Cu+ + (catión) y SO4 (anión) y se mueven libremente en la solución.
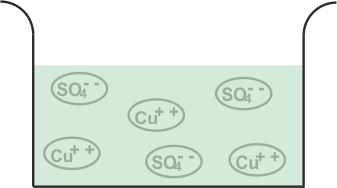

Ahora vamos a sumergir dos electrodos de cobre en esa solución.
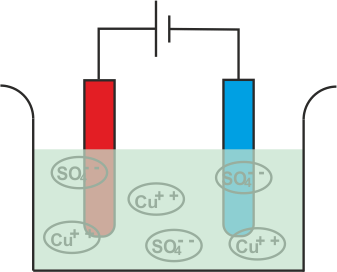

El Cu+ + Los iones (catión) serán atraídos hacia el cátodo, es decir, el electrodo conectado al terminal negativo de la batería. Al llegar al cátodo, cada Cu+ + el ión tomará electrones de él y se convertirá en átomos de cobre neutros.
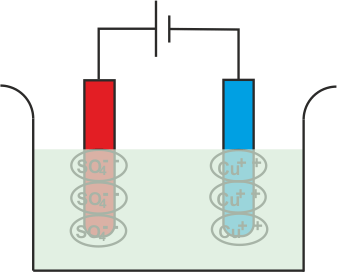

De manera similar, el SO4 (anión) los iones serán atraídos por el ánodo, es decir, el electrodo conectado al terminal positivo de la batería. Así que el SO4 los iones se moverán hacia el ánodo donde ceden dos electrones y se convierten en SO4 radical.
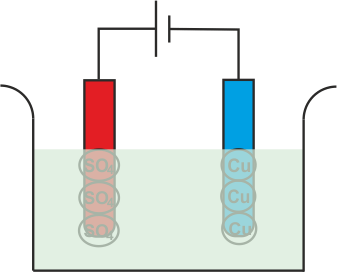

Pero como SO4 El radical no puede existir en el estado eléctrico neutro, atacará el ánodo de cobre y formará sulfato de cobre.
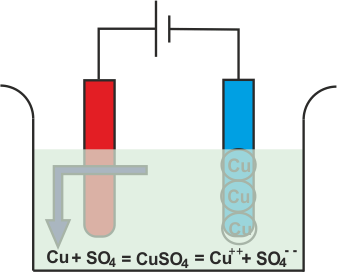

En el proceso anterior, después de tomar electrones los átomos de cobre neutros se depositan en el cátodo. Al mismo tiempo, el SO4 reacciona con el ánodo de cobre y se convierte en CuSO4 pero en el agua no puede existir como moléculas individuales en lugar de ese CuSO4 se dividirá en Cu+ +, SO4 y se disuelven en agua. Por lo tanto, se puede concluir que, durante la electrólisis del sulfato de cobre con electrodos de cobre, el cobre se deposita en el cátodo y la misma cantidad de cobre se elimina del ánodo. Si durante electrolisis de sulfato de cobreutilizamos electrodos de carbono en lugar de cobre u otros electrodos metálicos, entonces electrolisis las reacciones serán un poco diferentes. En realidad SO4 no puede reaccionar con el carbono y en este caso el SO4 reaccionará con el agua de la solución y formará ácido sulfúrico y liberará oxígeno.


El proceso descrito anteriormente se conoce como electrolisis.