Todos hemos visto ciruelas en el relleno. Anteriormente se pensaba que los electrones en un átomo se distribuyen con carga positiva como las ciruelas en un pudín. En otras palabras, se pensaba que la carga positiva existe en todo el átomo y que los electrones negativos están distribuidos de forma desigual en él como las ciruelas en el pudín. Este concepto del modelo atómico es tan conocido como el modelo de los átomos de ciruelas en el pudín. Este concepto fue introducido por J.J.Thomson, quien también fue el inventor de los electrones. Según ciruelas en el modelo de pudínLas cargas positivas y negativas de un átomo se distribuyen por todo el cuerpo del átomo y no debe haber ninguna masa concentrada en un átomo.
En 1899, Ernest Rutherford de la Universidad de Manchester había descubierto partículas alfa que son iones de helio con carga positiva emitidos por una sustancia radiactiva como el uranio. Estas partículas alfa crean puntos brillantes cuando golpean una pantalla recubierta de sulfuro de zinc. Como no hay masa concentrada en un átomo, se predijo que si una fina lámina metálica es bombardeada con partículas alfa con carga positiva, entonces todas esas partículas alfa pasarían la lámina sin mucha desviación en su trayectoria de viaje.
El pequeño campo eléctrico desarrollado en los átomos no puede afectar mucho el movimiento de la partícula. Así que se predijo que puede haber menos de 1o …desviación en el camino del movimiento de las partículas alfa. Esta predicción inspiró a Ernest Rutherford a realizar los experimentos para verificar las ciruelas en el modelo de pudín de los átomos. Instruyó a sus colegas científicos Ernest Marsden y Hans Geiger para que bombardearan con partículas alfa una fina lámina metálica para verificar esta predicción. Según las instrucciones, Ernest Marsden y Hans Geiger realizaron un experimento e hicieron historia. Colocaron una película de oro muy fina delante del cañón de rayos alfa. También colocaron una pantalla de sulfuro de zinc alrededor de la película de oro para observar los puntos brillantes en ella cuando las partículas alfa golpean sobre ella. Realizaron el experimento en una habitación oscura. Observaron durante el experimento que, como se predijo, las partículas alfa están cruzando la película y golpeando la pantalla de sulfuro de zinc que está detrás de la película.
Pero después de contar los puntos brillantes en la pantalla encontraron que llegó un resultado inesperado. Todas las partículas alfa no cruzaron la lámina en forma recta como se esperaba. Muy poco porcentaje de las partículas alfa bombardeadas cambiaron su forma de viajar durante el cruce de la lámina de oro. No sólo las partículas se desviaron de su camino, sino que también muy pocas de ellas rebotaron directamente hacia la fuente o el cañón alfa. Después de un estudio detallado de la observación, Ernest Marsden y Hans Geiger presentaron un informe a Ernest Rutherford. Después de ver y estudiar su informe, Rutherford predijo un modelo diferente de un átomoque se conoce como El modelo del átomo de Rutherford.
Predijo que las partículas alfa que rebotaron directamente deben haber colisionado con alguna masa mucho más pesada y que esa masa debe estar cargada positivamente. También se encontró que algunas de las partículas alfa desviadas no rebotan pero tienen un ángulo de desviación muy grande. Observando los diferentes ángulos de desviación y el número de partículas desviadas con estos ángulos predijo que las partículas alfa positivas también están influenciadas por una carga positiva concentrada comparativamente enorme. Declaró que las concentraciones de masa y carga positiva están en el mismo lugar en un átomo y que éste se encuentra en el centro del átomo y lo llamó como núcleo del átomo. También declaró que excepto el núcleo central, todo el espacio del átomo está vacío.
Después de este experimento con lámina de oro, Rutherford dio un modelo más realista de un átomo. Este modelo también se llama Modelo atómico nuclear o Modelo planetario del átomo. Este modelo se da en el año 1911. De acuerdo con Modelo atómico de Rutherfordscasi toda la masa de un átomo se concentra en este núcleo. Este núcleo está cargado positivamente y está rodeado por pequeñas partículas de luz cargadas negativamente, que se llaman electrones. Estos electrones circulan alrededor del núcleo de la misma manera que los planetas circulan alrededor del sol en el sistema planetario. Por eso este modelo también se conoce como el Modelo planetario del átomo.
El radio del núcleo es de aproximadamente 10-13 cm. El radio de la trayectoria circular recorrida por los electrones alrededor del núcleo es de unos 10-12 cm que es mayor que el diámetro de un electrón. El radio del átomo es alrededor de 10-8 cm. Así, como un sistema planetario, el átomo también es de naturaleza extremadamente abierta, debido a lo cual puede ser penetrado por partículas de alta velocidad de varios tipos. El Modelo Atómico Planetario de Rutherfords se muestra en la siguiente figura…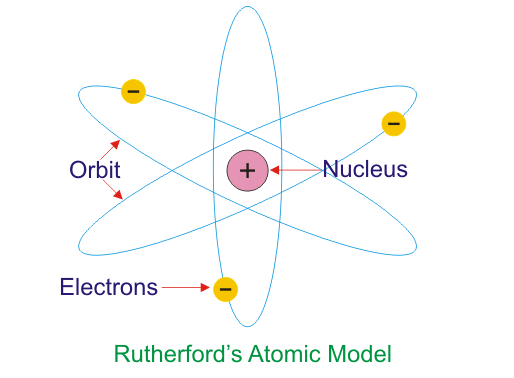

Existe una fuerza de atracción entre el núcleo cargado positivamente y los electrones cargados negativamente que viajan alrededor del núcleo. Esta fuerza electrostática entre el núcleo cargado positivamente y los electrones cargados negativamente es similar a la fuerza de atracción gravitacional entre el Sol y los planetas que giran alrededor del Sol. La mayor parte de la parte de este átomo planetario es espacio abierto, que no ofrece ningún resistencia para los pases de partículas diminutas con carga positiva como las partículas Alfa.
El núcleo del átomo es muy pequeño, denso y cargado positivamente, lo que resulta en la dispersión de partículas con carga positiva. Este fenómeno de dispersión de partículas alfa con carga positiva por el núcleo con carga positiva, explica la dispersión de partículas alfa con carga positiva por la lámina de oro, tal como lo observó Ernest Rutherford. El Modelo atómico Ernest Rutherford logró reemplazar el modelo atómico El modelo de Thomsons Plum Pudding dado por el físico inglés Sir J.J. Thomson.
Según el modelo atómico de Ernest Rutherfords, los electrones no están unidos a la masa del átomo. Los electrones son estacionarios en el espacio o giran en trayectorias circulares alrededor del núcleo. Pero si los electrones son estacionarios deben caer al núcleo debido a la fuerza de atracción entre el electrón y el núcleo. Por otro lado, si los electrones se mueven en una trayectoria circular, entonces según la teoría electromagnéticala carga acelerada de los electrones habría perdido continuamente su energía y habría bajado al núcleo, como se muestra en la siguiente figura El modelo atómico de Rutherford no explica por qué los electrones no caen en el núcleo de carga positiva.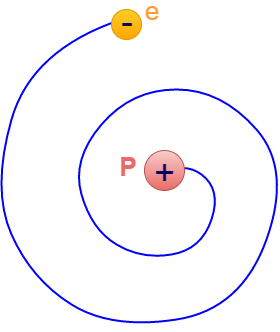

Así, las deficiencias del modelo atómico de Rutherfords pueden describirse como
- El El modelo atómico de Rutherfords no explica la distribución de los electrones en las órbitas.
- El modelo atómico de Rutherfords no explica la estabilidad de la átomo como un todo.
Los inconvenientes anteriores de El modelo atómico de Rutherfords fueron superados por Modelo atómico de Bohrs (1913).