Fue introducida por el físico danés Niels Bohr en el año 1913. Según este modelo, el átomo consiste en un pequeño núcleo en el centro y electrones que giran en órbitas circulares que rodean el núcleo similar a sistema solar. Pero aquí, la fuerza de atracción es proporcionada por fuerzas electrostáticas en lugar de fuerzas gravitacionales. El núcleo está cargado positivamente y los electrones están cargados negativamente. Más adelante Niels Bohr ilustró que el núcleo cargado positivamente consiste en protones y neutrones. Los protones están cargados positivamente y los neutrones no tienen ninguna carga. Niels Bohr introdujo la teoría cuántica para superar los inconvenientes de El modelo atómico de Rutherfords. De acuerdo con esta teoría
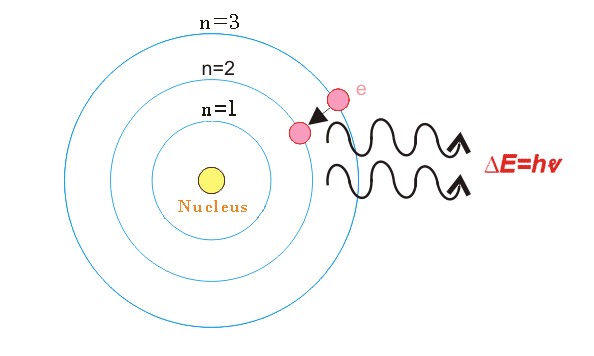
- Los electrones giran alrededor del núcleo en ciertas órbitas. Cada órbita tiene cierto nivel de energía. Estas órbitas se llaman órbitas estacionarias. La órbita cercana al núcleo tiene un nivel de energía bajo y la órbita exterior tiene un nivel de energía más alto.
Un electrón puede girar en cierto nivel de energía sin perder nada de energía. Al añadir energía a la átomoel electrón salta a una órbita de mayor nivel de energía.
Por otro lado, cuando el electrón salta de la órbita de mayor nivel de energía a la órbita de menor nivel de energía, el electrón libera la energía en pequeños paquetes. Estos pequeños paquetes se llaman quanta o fotones. La energía de los fotones viene dada por,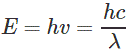
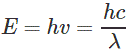
- La fuerza centrípeta debida a la atracción electrostática entre el núcleo cargado positivamente y el electrón cargado negativamente es igual a la fuerza centrífuga del electrón que se mueve en órbitas circulares.
- El momento angular del electrón que se mueve en órbitas circulares es el múltiplo integral de
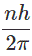
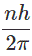
Donde, n es un número entero llamado número cuántico. - El radio de la órbita es proporcional a n2 y la velocidad del electrón es inversamente proporcional a n. Estas suposiciones condujeron a resultados que se han considerado correctos de ser probados.
Dónde,
h es la constante de los tablones,
es la frecuencia de la luz (en Hz),
c es la velocidad de la luz (en m/seg),
es la longitud de onda de la luz emitida (en metros).

Este modelo también tiene algunas deficiencias que se enumeran a continuación-
- Se aplica a un átomo de electrón, es decir, al átomo de hidrógeno. No se puede ampliar fácilmente para explicar los átomos más complicados.
- No da ninguna regla o restricción con respecto a la transición de un electrón de una órbita a otra.
- Introdujo sólo un número cuántico n. En cambio, las pruebas experimentales relativas a la estructura fina de la línea espectral sugieren los números cuánticos más adicionales.
- La explicación cuantitativa de la unión química no puede ser explicada por la El modelo atómico de Bohrs.