Batería de zinc-carbón
Zinc-carbón batería se está utilizando popularmente durante los últimos 100 años. Generalmente hay dos tipos de pila de zinc-carbón la batería de Leclanche y la batería de cloruro de zinc generalmente disponibles. Ambas son baterías primarias. Esta batería fue inventada por Goerge Lionel Leclanche en 1866. Esta fue la primera batería en la que se utilizó un electrolito poco corrosivo como el cloruro de amonio. Antes de eso sólo se usaban ácidos minerales fuertes como electrolito del sistema de la batería.
En esta celda de la batería, se usó un frasco de vidrio como contenedor principal. El contenedor se llenó con una solución de cloruro de amonio como electrolito. Una varilla de zinc amalgamada fue sumergida en este electrolito como electrodo negativo o ánodo. En esta celda de la batería de Leclanche, se llenaba un pote poroso con una mezcla uno a uno de dióxido de manganeso y polvo de carbono. Una varilla de carbono fue insertada en esta mezcla.
El pote poroso junto con la mezcla y la varilla de carbono sirvió como electrodo positivo o cátodo y esto se colocó en la solución de cloruro de amonio en el frasco. En 1876, el propio Leclanche mejoró su propio diseño de prototipo de batería de zinc-carbón. Aquí mezcló un aglutinante de goma de resina con dióxido de manganeso y polvo de carbón para formar un bloque sólido comprimido de la mezcla por presión hidráulica. Debido a esta estructura sólida de la mezcla catódica, ya no hay necesidad de una vasija porosa en la celda de la batería de Leclanche. En 1888, el Dr. Carl Gassner, desarrolló la construcción de la celda de Leclanche. Aquí utilizó una pasta de yeso de París y cloruro de amonio como electrolito, en lugar de cloruro de amonio líquido. En lugar de insertar una varilla de zinc dentro del electrolito en un recipiente de vidrio, hizo el recipiente por el propio zinc. Por lo tanto, este recipiente también sirve como ánodo de la batería. Minimizó la acción química local en su batería envolviendo telas saturadas de cloruro de amonio y de zinc al bloque de mezcla de cátodos cilíndricos.
Más tarde reemplazó el yeso de París por harina de trigo, en una mezcla de electrolitos. Este fue el primer diseño comercial de pila seca de zinc-carbón. Este no fue el final del viaje. La batería de Leclanche fue desarrollada para satisfacer la demanda del mercado en el 20th siglo. Más tarde, el carbono negro de acetileno se utilizó como colector de corriente catódica. Este es más conductor que el grafito. También se ha desarrollado el diseño de separadores y el sistema de sellado de ventilación.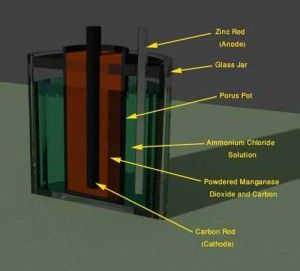

Después de 1960, se dirigieron más esfuerzos al desarrollo de la pila de cloruro de zinc. Esta es también una versión popular de batería de zinc-carbón. Aquí, el cloruro de zinc se utiliza como electrolito en lugar del cloruro de amonio. Esto fue desarrollado para proporcionar un mejor rendimiento en la aplicación de drenaje pesado. En otras palabras, la pila de cloruro de zinc es un sustituto mejorado de la pila Leclanche en las aplicaciones de drenaje pesado.
Reacción química en una batería de zinc-carbón
En la celda de la pila de Leclanche, el zinc se utiliza como ánodo, el dióxido de manganeso como cátodo y el cloruro de amonio como electrolito principal, pero hay un porcentaje de cloruro de zinc en el electrolito. En la celda de batería de cloruro de zinc, el zinc se utiliza como ánodo, el dióxido de manganeso como cátodo y el cloruro de zinc como electrolito.
En ambas pilas de zinc-carbón, durante la descarga, el ánodo de zinc participa en la reacción de oxidación y cada átomo de zinc que participa en esta reacción libera dos electrones.

Estos electrones llegan al cátodo a través de un circuito de carga externa.
En la celda de la batería de Leclanche, el cloruro de amonio (NH4Cl) existe en la mezcla de electrolitos como NH4+ y Cl –. En el cátodo MnO2 se reducirá a Mn2O3 en reacción con el ion amonio (NH4+). Además de Mn2O3 esta reacción también produce amoníaco (NH3) y el agua (H20).

Pero durante este proceso químico algunos de los iones de amonio (NH4+ ) se reducen directamente por los electrones y forman amoníaco gaseoso (NH3) e hidrógeno(H2).

En una pila de zinc-carbón, este gas amoniaco reacciona con el cloruro de zinc (ZnCl2) para formar cloruro de zinc y amonio sólido y el hidrógeno gaseoso reacciona con el dióxido de manganeso para formar trióxido de di-manganeso sólido y agua. Estas dos reacciones evitan la formación de presión de gas durante la descarga de la batería.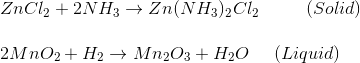
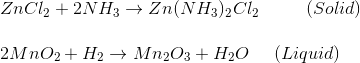
La reacción general es,

Una pila de cloruro de zinc es una versión mejorada de la pila de zinc-carbón. Estas pilas generalmente se etiquetan como pilas de alta resistencia. Una pila de cloruro de zinc sólo contiene cloruro de zinc (ZnCl2) de la pasta como electrolito. Esta batería proporciona más corriente, más voltaje y más vida que una batería de zinc-carbón de uso general. La reacción del cátodo es,

La reacción general es,

Tensión nominal de la batería de zinc-carbón
El voltaje estándar de una pila de zinc-carbón está determinado por el tipo de ánodo y los materiales catódicos utilizados en la célula de la pila. En la celda de la pila de zinc-carbón, el zinc es el material del ánodo y el dióxido de manganeso es el material del cátodo. El potencial de los electrodos de zinc es de 0,7 voltios, mientras que el potencial de los electrodos de dióxido de manganeso es de 1,28.
Por lo tanto, el voltaje teórico de cada celda debería ser (- 0,76) + 1,23 = 1,99 V, pero considerando muchas condiciones prácticas, la salida de voltaje real de una pila estándar de zinc-carbón no es superior a 1,5 V.
Densidad energética de la célula de batería de zinc-carbón
El peso molar del material catódico, el dióxido de manganeso es de 87 g/mol. Aquí en la reacción de la pila se encuentra que dos electrones reducen dos moléculas de dióxido de manganeso. Por lo tanto, según la constante de Faraday, 28,6 Ah pueden ser entregados por la reducción completa de un molar o 87 g de dióxido de manganeso. Por lo tanto, 87/26,8 = 3,24 g de dióxido de manganeso es necesario para entregar 1 Ah de electricidad.
El peso molar del ánodo, material de zinc es de 65 g/mol. Aquí en la reacción de la pila se encuentra que dos electrones oxidan un átomo de zinc. Por lo tanto, según la constante de Faraday, 28,6 Ah pueden ser entregados por la oxidación completa de un molar o 65/2 g o 32,5 g de zinc. Por lo tanto, 32,5/26,8 = 1,21 g de zinc es necesario para entregar 1 Ah de electricidad.
La densidad energética total de la pila de zinc-carbón es de 3,24 g/Ah + 1,21 g/Ah = 4,45 g/Ah =1 / 4,45 Ah/g = 0,224 Ah/g o 224 Ah/Kg. Este es un cálculo absolutamente teórico, pero en la práctica muchos otros materiales como, electrolito, negro de carbón, agua a incluir en la pila, cuyo peso no puede ser omitido. Además de estas muchas otras condiciones prácticas deben ser consideradas en una batería. Teniendo en cuenta todo lo anterior, una batería Leclanche de baja descarga práctica tiene una densidad de energía de 75 Ah/Kg y lo mismo para una batería de alta carga y descarga intermitente, es de unos 35 Ah/Kg.
Tipos de Batería de Carbono de Zinc
Como dijimos antes, hay dos tipos de pila de zinc-carbón .
- Batería de Leclanche
- Batería de cloruro de zinc.
De nuevo la batería de Leclanche es de dos tipos principales, células de uso general y células de uso pesado.
En la batería de bajo coste de Leclanche de uso general, se utiliza zinc puro como ánodo, el cloruro de amonio se utiliza como electrolito principal junto con un porcentaje de cloruro de zinc. Aquí se utiliza el mineral de dióxido de manganeso natural como material catódico. Estas pilas se utilizan generalmente cuando el coste es un factor más vital que su rendimiento.
La aplicación de la pila Leclanche de alta resistencia está dominada por la pila de cloruro de zinc, pero aún así algunos de los fabricantes siguen produciendo pilas Leclanche de alta resistencia añadiendo dióxido de manganeso electrolítico o químico junto con mineral de dióxido de manganeso como cátodo.
En las pilas de cloruro de zinc de uso general, el zinc puro se utiliza como ánodo; el cloruro de zinc se utiliza como electrolito. A veces se añade al electrolito una pequeña cantidad de cloruro de amonio. Aquí también se utiliza el mineral de dióxido de manganeso natural como material catódico.
Para aplicaciones industriales de trabajo pesado, se añade dióxido de manganeso electrolítico al dióxido de manganeso natural del mineral en el cátodo. Estas baterías compiten en costo con la batería de alta resistencia de Leclanche. Esta batería tiene pocas fugas, en comparación con la celda de Leclanche.
En la celda de cloruro de zinc de uso extra o súper pesado, se añade una cantidad muy pequeña de cloruro de amonio al electrolito de cloruro de zinc. La cantidad de cloruro de zinc debe ser inferior al 1% del peso de su cátodo. El mineral óxido de manganeso es reemplazado por el electrolito óxido de manganeso en los materiales del cátodo. Estas celdas utilizan un separador de papel recubierto con almidones reticulados o modificados, que mejoran su estabilidad en el electrolito. La batería de cloruro de zinc de uso extra o superpesado se utiliza cuando se requiere un alto rendimiento, incluso a costa de un alto gasto. Funciona bien a baja temperatura, lo que no es posible en el caso de la célula de Leclanche.
Tipos de baterías de zinc-carbón según su tamaño
| Tamaño | Peso | Diámetro | Altura | Figura de referencia |
| N | 6,2 gramos | 12 mm | 30.2 mm | 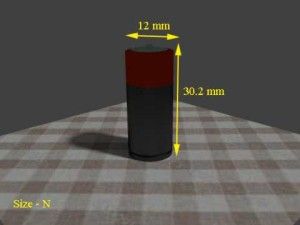  |
| AAA | 8,5 gramos | 10.5 mm | 44.5 mm | 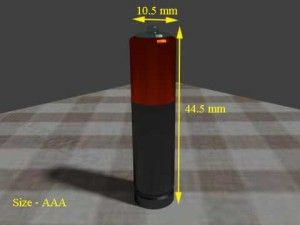  |
| AA | 15 gramos | 14.5 mm | 50.5 mm | 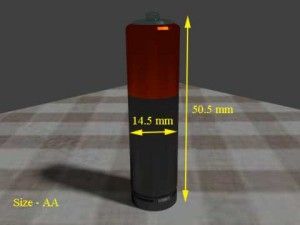  |
| C | 41 gramos | 26,2 mm | 50 mm | 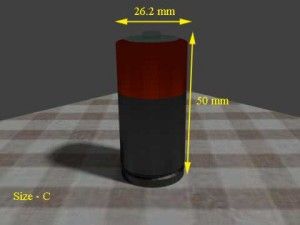  |
| D | 90 gramos | 34.2 mm | 61.5 mm | 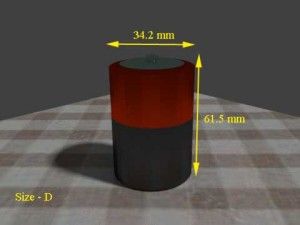  |
| F | 160 gramos | 34 mm | 92 mm |   |
| No 6 | 900 gramos | 67 mm | 170 mm |   |
Ventajas y desventajas de la batería de zinc-carbón
Las ventajas de Batería de zinc-carbón pueden ser listados como sigue.
Ventajas de la Batería Leclanche
- El costo de esta batería es bastante bajo.
- Se dispone fácilmente de varias formas, tamaños y capacidades de estas células.
- Una fiabilidad tradicional de larga data.
Desventajas de la batería de Leclanche
- Su densidad de energía es bastante baja.
- Da un mal servicio a baja temperatura.
- Tiene una pobre fuga resistencia.
- No puede funcionar de manera eficiente con la aplicación de la corriente de drenaje de alta intensidad.
- La vida propia no es muy buena.
- Su voltaje cae constantemente con la descarga.
Ventajas de la batería de cloruro de zinc
- Una mayor densidad de energía está disponible en la pila de cloruro de zinc.
- La batería de cloruro de zinc tiene una alta eficiencia en condiciones de fuerte descarga.
- Tiene mejor rendimiento a baja temperatura.
- Una menor resistencia a las fugas.
Desventajas de la batería de zinc-carbón
- La tasa de gasificación de esta batería es mayor.
- Esto es más sensible al oxígeno.